|
|
В журнале "Терапевт" (Входит в Перечень изданий ВАК) вышла статья главного врачаМиокардиальный фиброз и инсулиноподобный фактор роста-1
при артериальной гипертензии, связь cо структурно-функциональными изменениями сердца В.А. Разин, канд. мед. наук, доц., Р.Х. Гимаев, канд. мед. наук, доц., Е.В. Мовчан, канд. мед. наук 1 Медицинский факультет ГОУ ВПО «Ульяновский государственный университет»; 2 ГУЗ «Областной кардиологический диспансер», г. Ульяновск Резюме. Статья посвящена изучению миокардиального фиброза и уровня инсулиноподобного фактора роста-1 у пациентов с артериальной гипертензией в зависимости от типа ремоделирования левого желудочка. Выявлено нарастание количества коллагена в миокарде при артериальной гипертензии. Обнаружена связь процессов миокардиального фиброза с содержанием инсулиноподобного фактора роста-1 в плазме крови. Ключевые слова: артериальная гипертензия, объемная фракция интерстициального коллагена, миокардиальный фиброз, инсулиноподобный фактор роста-1, ремоделирование миокарда, геометрия левого желудочка. MYOCARDIAL FYBROSIS A ND I NSULINOID GROWTH FACTOR-1 I N CASE OF AR TERIAL HYPERTENSION A ND I TS CONNECTION WITH S TRUCTURAL FUNCTIONAL CARDIAC CHANGES V.A. Razin, MD, Ph.D., Assoc. Prof., R.Kh. Gimaev, MD, Ph.D., Assoc. Prof., E.V. Movchan, MD, Ph.D. (Ul'yanovsk) Summary. The аrticle is devoted to myocardial fibrosis studies and studies of insulinoid growth factor-1 level in arterial hypertension patients in dependence of left ventricle remodeling type. It is fixed the increase of collagen in myocardium in arterial hypertension case. It is found the correlation of myocardial fibrosis processes with insulinoid growth factor-1 content in blood plasma. Key words: arterial hypertension, three-dimensional interstitial collagen fraction, myocardial fibrosis, insulinoid growth factor-1, myocardium remodeling, left ventricle geometry. Введение Артериальная гипертензия (АГ) является величайшей в истории человечества неинфекционной пандемией, определяющей структуру сердечно-сосудистой заболеваемости и смертности. Ремоделирование миокарда при гипертонической болезни – адаптивный ответ сердца на длительное воздействие различных физиологических и патогенных факторов, вызывающих изменения структуры кардиомиоцитов и экстра- целлюлярного матрикса. В процессе формирования гипертензивного сердца происходит структурная перестройка компонентов стенки нор- мального желудочка, что проявляется гипертрофией кардиомиоцитов, пролиферацией фибробластов, фиброзом и клеточной смертью [2, 4]. Основу патологической гипертрофии миокардалевого желудочка (ГЛЖ) при гипертонической болезни составляет не сам рост кардиомиоцитов, а ремоделирование внеклеточного пространства. Аномальная структура миокарда характеризуется чрезмерным и непропорциональным интерсти- циальным фиброзом. Эти изменения принимают участие в развитии диастолической и сократительной дисфункции сердца, прогрессировании хронической сердечной недостаточности [15]. Внастоящее время многие авторы считают, что в процессе возникновения и прогрессирования хронической сердечной недостаточности, в процессах ремоделирования миокарда основную роль играет дисбаланс нейрогормональных фак- торов, вызывающих пролиферацию, изменения структуры внеклеточного матрикса и апоптоз клеток [12]. В последние годы установлено, что в ремоделировании миокарда участвуют медиаторы межклеточного взаимодействия: цитокины и «факторы роста пептидной природы», из них наиболее важным является инсулиноподобные факторы роста-1 (ИПФР-1) [1, 6]. Цель работы. Изучение миокардиального фиброза у пациентов с артериальной гипертензией, определение уровня инсулиноподобного фактора роста-1 в сыворотке крови у больных разными типами ремоделирования левого желудочка (ЛЖ). Материалы и методы. Обследовано 152 пациента с артериальной гипертензией 1–2 стадии. Для оценки характера структурного ремоделирования ЛЖ проводили эхокардиографию в соответствии с рекомендациями Американского эхокардиографического общества [9]. Из парастернального доступа в М-режиме определяли конечно-диастолический (КДР) и конечно-систолический (КСР) размеры, конечно-диастолический (КДО) и конечно- систолический (КСО) объемы, толщину межжелудочковой перегородки (ТМЖП) и задней стенки ЛЖ (ЗСЛЖ), индекс КДР (ИКДР). Массу миокарда ЛЖ (ММЛЖ) рассчитывали по формуле Penn Convention [5, 11]: ММЛЖ = 1,04 х [(КДР+ТМЖП+ Индекс ММЛЖ (ИММЛЖ) ЛЖ определяли поТЗСЛЖ)3 - КДР3] - 13,6. следующей формуле: ИММ ЛЖ = ММЛЖ / ППТ, где: ППТ – площадь поверхности тела. Относительную толщину стенки (ОТС) ЛЖ рассчитывали по формуле: ОТС = ТМЖП + ТЗСЛЖ / КДР. ГЛЖ диагностировали при величине ИММЛЖ более 125 г/м2 для мужчин и более 110 г/м2 для женщин (критерии ВНОК, 2008). Типы структурно-геометрического ремоделирования определяли в соответствии с принципом A. Ganau [7]: нормальная геометрия (НГ) ЛЖ (ОТСЛЖ < 0,45, без ГЛЖ); концентрическое ремоделирование (КР) ЛЖ (ОТСЛЖ > 0,45, без ГЛЖ); концентрическая гипертрофия ЛЖ (КГЛЖ) (ОТСЛЖ > 0,45, с ГЛЖ) и эксцентрическая гипертрофия ЛЖ(ЭГЛЖ) (ОТСЛЖ < 0,45, с ГЛЖ). В зависимости от геометрии левого желудочка пациенты были разделены на 4 группы. В 1-ю группу вошли пациенты с АГ с нормальной геометрией левого желудочка (19 мужчин и 16 жен- щин, средний возраст – 51,20 ± 2,92 года, длительность заболевания – 5,41 ± 1,84 года), во 2-ю группу вошли пациенты с АГ с эксцентри- ческой гипертрофией левого желудочка (25 мужчин и 21 женщина, средний возраст – 53,42 ± 2,43 года, длительность заболевания – 6,81 ± 1,61 года), в 3-ю группу вошли пациенты с АГ с концентрической гипертрофией левого желудочка (28 мужчин и 25 женщин, средний возраст – 54,29 ± 4,09 года, длительность заболевания – 6,74 ± 1,55 года), в 4-ю группу вошли пациенты с АГ с концентрической гипертрофи- ей левого желудочка (10 мужчин и 8 женщин, средний возраст – 55,17 ± 5,11 года, длительность заболевания – 6,17 ± 2,15 года). Миокардиальный интерстициальный фиброз рассчитывался по формуле J. Shirani и соавт. определяющей [13] объемную фракцию интерстици- ального коллагена (ОФИК): ОФИК (%) = {1-1,3 х [(общий QRS (мм) х рост (м)] : ММЛЖ (г)}х100. В сыворотке крови пациентов определяли концентрацию инсулиноподобного фактора роста-1. Результаты исследования. В ходе исследования было проведено сравнение процентного содержания коллагена у лиц контрольной группы и пациентов с артериальной гипертензией. В нашем исследовании процентное содержание коллагена в миокарде у лиц контрольной группы составило 1,58 ± 0,34%, в то время как у пациентов страдающих артериальной гипертензией 1–2 стадий ОФИК составила 4,36 ± 1,29%, различие данного параметра имело статистиче- скую значимость (р < 0,00001) (рис. 1). 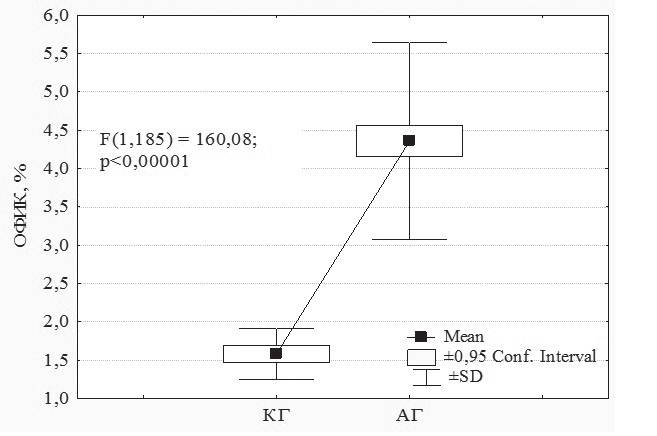 Рис. 1. Объемная фракция интерстициального коллагена у пациентов с артериальной гипертензии. Примечание: КГ – контрольная группа Таким образом, в ходе настоящего исследования установлено, что содержание коллагена в миокарде пациентов страдающих артериальной гипертензией в больше, чем у лиц без артериальной гипертензии. Даже в группе больных АГ с нормальным типом геометрии ЛЖ наблюдались достоверно более высокие значения ОФИК – в среднем 3,03 ± 0,78% (р < 0,0001). Анализируя показатели ОФИК в группах больных АГ с различным типом геометрии ЛЖ было установлено, что наибольшее его значение наблюдалось у пациентов с концен- трической гипертрофией – 5,34 ± 0,97% (р <0,0001 по сравнению с нормальной геометрией). В группе больных с концентрическим ремоделиро- ванием значение ОФИК составило 3,66 ± 0,96% (р < 0,0001 по сравнению с нормальной геометрией); у пациентов с эксцентрической ГЛЖ – 4,47 ±0,98% (р < 0,0001 по сравнению с нормальной геометрией) (рис. 2). 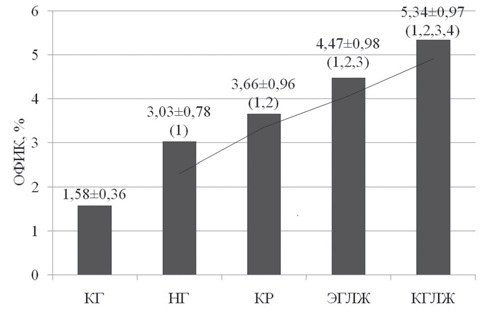 Рис. 2. Объемная фракция интерстициального коллагена при различных типах геометрии левого желудочка. Примечание: КГ– контрольная группа; 1 – р < 0,0001 в сравнении с КГ, 2 – р < 0,0001 в сравнении с НГ, 3 – р < 0,0001 в сравнении с КР, 4 – р < 0,0001 в сравнении с ЭГЛЖ В ходе нашей работы была изучена ОФИК у пациентов с артериальной гипертензией в зависимости от наличия у них, при эхокардиографиче- ском исследовании, диастолической дисфункции левого желудочка (рис. 3). 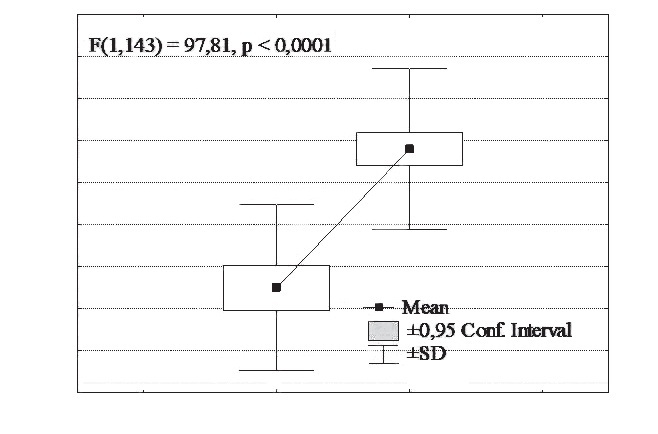 Рис. 3. Объемная фракция интерстициального коллагена у пациентов с АГ в зависимости от наличия диастолической дисфункции ЛЖ Было выявлено, что пациенты с нарушенной диастолической функцией ЛЖ имели статистически значимо более высокое значение ОФИК. Проводя сравнительный анализ уровня ИПФР-1 в группах больных АГ с различным типом ремоделирования было установлено, что концентрация ИПФР-1 в контрольной группе не имела статистического отличия от концентрации ИПФР-1 у пациентов с нормальной геометрией ЛЖ, с концентрическим ремоделированием и концентрической гипертрофией ЛЖ (рис. 4). 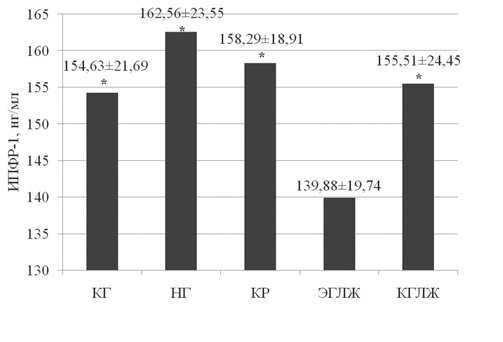 Рис. 4. Концентрация ИПФР-1 при различных типах геометрии левого желудочка. Примечание: КГ– контрольная группа; * – различие статистически значимо (р < 0,05 в сравнении с пациентами с ЭГЛЖ) Однако пациенты с эксцентрической гипертрофией ЛЖ имели статистически значимо более низкое значение ИПФР-1 в сравнении с кон- трольной группой (р = 0,0075), с пациентами с нормальной геометрией ЛЖ (р < 0,0001), с концентрическим ремоделированием (р = 0,0015) и концентрической гипертрофией ЛЖ (р = 0,0008). При проведении корреляционного анализа между уровнем ИПФР-1 и структурно- функциональными показателями сердца у пациентов с АГ было выявлено, что ИПФР-1 имеет статистически значимую корреляцию с большин- ством параметров ЭХО-кардиографии, так выявлено – отрицательная корреляция средней степени с КДР (r = -0,48, р = 0,0001) и КСР (r = -0,33, р = 0,0001), отрицательная корреляция средней степени с КДО (r = -0,42, р = 0,0008) и КСО (r = -0,35, р = 0,0001), отрицательная корреляция средней степени с УО (r = -0,40, р = 0,0001), слабая отрицательная корреляция с толщиной задней стенки ЛЖ в систолу (r = -0,30, р = 0,0004) и толщиной ЗСЛЖ в диастолу (r = -0,28, р = 0,01), с ТМЖП в диастолу – (r = -0,40, р = 0,0001), отрицательная корреляция средней степени с ММЛЖ (r = -0,62, р < 0,0001) и ИММЛЖ (r = -0,54, р < 0,0001). Статистически значимых корреляций ИПФР-1 с фракцией выброса, фрак- цией укорочения, временем замедления максимальной скорости раннего наполнения (ВЗРН), временем изометрического расслабления ЛЖ (ВИР), миокардиальным стрессом (в систолу и диастолу) и выполняемой работой сердца выявлено не было. 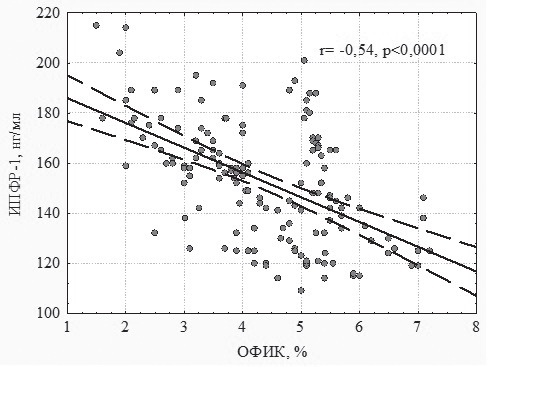 Рис. 5. Корреляционная связь ИПФР-1 с ОФИК у пациентов с артериальной гипертензией 1–2 стадии На рис. 5 представлен график корреляции ИПФР-1 с процентным содержанием коллагена в миокарде, как видно из графика выявлена статистически значимая обратная корреляция данных параметров. Т. е., у пациентов с артериальной гипертонией 1–2 стадии имеющих низкую концентрацию в крови ИПФР-1 отмечается более высокое содержание коллагеновых волокон в миокарде, что отражает нарастание миокардиального фиброза или, другими словами, ремоделирование миркардиального матрикса. Заключение В процесс сердечного ремоделирования вовлекаются все виды клеток, присутствующие в миокарде: кардиомиоциты, интерстициальные клетки, сосудистый эндотелий и иммунные клетки. На поздних стадиях гипертрофии отмечаются изменения клеточной организации и формы кардиомиоцитов, в последующем возникает утрата сократительных элементов и параллельного расположения саркомеров в кардиомиоцитах. Другой важный морфологический признак гипертонического сердца – увеличение содержания в миокарде коллагена и фиброзной ткани. Выявленное в ходе исследования увеличение содержания коллагена в миокарде пациентов с АГ, независимо от типа геометрии ЛЖ, свидетельствует о нарастаниях процессов миокардиального фиброза в сердце. Увеличение содержание коллагена в миокарде приводит к снижению растяжимости сердца в диастолу, что способствует развитию и прогрессированию диастолической дисфункции. Выявленное снижение уровня ИПФР-1 у пациентов с АГ с эксцентрической гипертрофией левого желудочка и наличие корреляции между уровнем ИПФР-1 и эхокардиографическими параметрамиподтверждает участие ИПФР-1 в структурно-функциональных изменениях миокарда ЛЖ у пациентов с артериальной гипертензией. Развитие ЭГЛЖ сопровождается уменьшением синтеза ИПФР-1 и доминированием на этом фоне процессов апоптоза кардиомиоцитов и фиброзирования миокарда. Эти процессы снижают сократительные свойства сердечной мышцы и ускоряют наступление сердечной недостаточности. Таким образом, снижение уровня ИПФР-1 является биохимическим маркером ухудшения анаболических процессов в миокарде, участвует в формировании гипертензивного сердца и прогрессирова- нии хронической сердечной недостаточности [3, 8, 10, 14], что подтверждается наличием связи между уровнем ИПФР-1 и содержанием коллаге-на в миокарде пациентов с АГ. Литература 1. Журавлева Л.В., Ковалева О.Н. Инсулиноподобный фактор роста и ремоделирование миокарда у больных с арте- риальной гипертензией // Український кардіологічний жур- нал. – 2006. – № 5. – С. 32–37. 2. Инжутова А.И. Ведение пациентов с артериальной гипер- тензией и ремоделированием сердца на амбулаторном этапе // Справочник поликлинического врача. – 2010. – № 6. – С. 26–28. 3. Anker S.D., Volterani M., Plaum C., et al. Acquired growth hormone resistance in patients with chronic heart failure: implications for therapy with growth hormone // J. Am. Coll. Cardiol. – 2001. – Vol. 38, № 2. – P. 443–452. 4. Bradford C. Berk, Keigi Fujiwara, Stephanie Lehoux. ECM remodeling in hypertensive heart disease // The Journal of Clinical Investigation. – 2007. – Vol. 117 (3). – P. 568–575. 5. Devereux R.B., Reichek N. Echocardiographic determination of left ventricular mass in man: anatomic validation of the method // Circulation. – 1977. – Vol. 55. – P. 613–618. 6. Dignass A.U., Podolsky D.K. Peptide growth factors in inflammatory bowel disease // Cytokines in inflammatory bowel disease / Ed. C. Fiocchi, R.G. Landers. – N.Y.: Company, 1996. – P. 137–148. 7. Ganau A., Devereux R.B., Roman M.J. et al. Patterns of left ventricular hypertrophy and geometric remodeling in essential hypertension // J. Amer Coll. Cardiology. – 1992. – Vol. 19. – P. 1550–1558. 8. Kovalyova O., Asheulova T., Ambrosova T. Relationship between tumor necrosis factor-alpha, interleukin-1, Left ventricular mass and platelet adhesion in hypertension // X European meeting on Hypertension. – Geteborg. – 2000. – P. 124. 9. Levy D., Svage D., Garrison R. I., et al. Echocardiographic criteria for left ventricular hypertrophy (The Framingham Heart Study) // Amer. J. Cardiology. – 1987. – Vol. 59. – P. 956–960. 10. Niebauer J., Pflaum C., Clark A.L., et al. Deficient insulin-like growth factor-1 in chronic heart failure predicts altered body composition, anabolic deficiency, cytokine and neirohormonal activation // J. Am. Coll.Cardiol. – 1998. – Vol. 32, № 2. – P. 393–397. 11. Palmeri V., Dahlif B., DeQuattro V. et al. Reliability of echocardiographic assessment of left ventricular structure and function: The Preserve Study // J. Amer. Coll. Cardiology. – 1999. – Vol. 34. – P. 1625–1632. 12. Skvortsov A., Mareev V., Podzarskaya N., Litonova G., Baklanova N., Belenkov Y. Effect of long-term therapy with betablocker carvedilol on renin-angiotensin-aldosterone system activity: comparative study with angiotensin-converting enzyme inhibitor enalapril in congestive heart failure // European Journal of Heart Failure. – 2006. – Vol. 5 (1). – P. 120. 13. Shirani J., Pick R., Quo Y. Usefulness of the Electrocardiogram and Echocardiogram in predicting the amount of interstitial myocardial collagen in endomyocardial biopsy specimens of patients with chronic heart failure // Am. J. Cardiol. – 1992. – Vol. 69. – P. 1502. 14. Van den Berghe G. Endocrine evaluation of patients with critical illness // Endocrinol. Metab. Clinics. – 2003. – Vol. 32, № 7. – P. 11–19. 15. Weber K.T. Monitoring tissue repair and fibrosis from a distance // Circulation. – 1997. – Vol. 96. – P. 2488–2492. Статья поступила — 21.10.2011 г. Авторы и контакты: Разин Владимир Александрович, кандидат медицинских наук, доцент, доцент кафедры факультетской терапии меди- цинского факультета УлГУ, эл. почта: razin1975@mail.ru; Гимаев Ринат Худзятович, кандидат медицинских наук, доцент, доцент кафедры факультетской терапии медицинского факультета УлГУ, эл. почта: gimaev78@rambler.ru; Мовчан Елена Викторовна, кандидат медицинских наук, главный врач ОКД, эл. почта: movchan-e@yandex.ru |

|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||





